/ Forschung
Wasser ist nicht gleich Wasser
Wassermoleküle kommen in zwei verschiedenen Formen mit fast identischen physikalischen Eigenschaften vor. Erstmals ist es nun gelungen, die beiden Formen zu trennen und dabei zu zeigen, dass sie unterschiedliche chemische Reaktivitäten aufweisen können. Das berichten Forschende der Universität Basel mit Kollegen in Hamburg in der Fachzeitschrift Nature Communications.
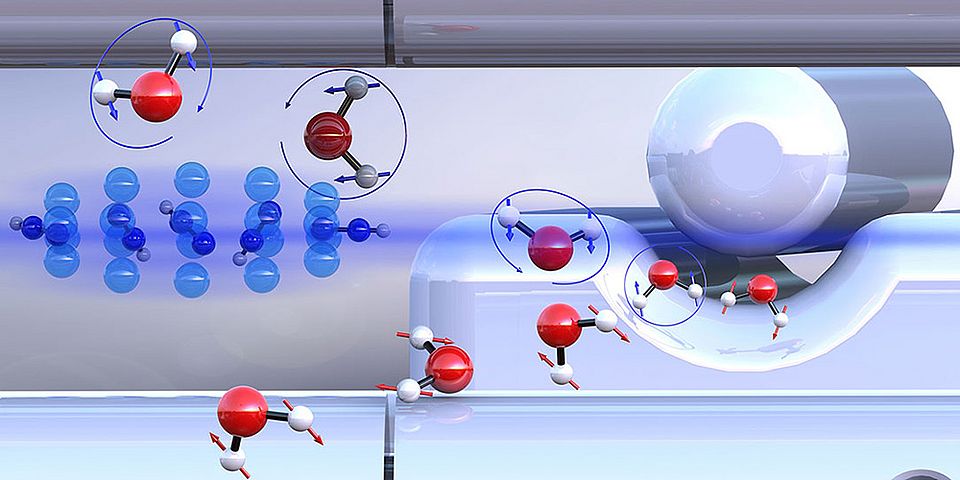
Chemisch gesehen ist Wasser ein Molekül, in dem ein einzelnes Sauerstoffatom mit zwei Wasserstoffatomen verknüpft ist. Weniger bekannt ist, dass Wasser auf molekularer Ebene in zwei unterschiedlichen Formen (Isomeren) existiert. Die Unterscheidung liegt in der Orientierung der Kernspins der beiden Wasserstoffatome. Je nachdem, ob die Spins der beiden Wasserstoffkerne im Molekül gleich oder entgegengesetzt ausgerichtet sind, spricht man von ortho- oder para-Wasser.
Experimente mit sortierten Wassermolekülen
Die Forschungsgruppe um Prof. Dr. Stefan Willitsch vom Departement Chemie der Universität Basel hat nun untersucht, wie sich die beiden Formen von Wasser in ihrer chemischen Reaktivität unterscheiden – ihrer Fähigkeit, eine chemische Reaktion einzugehen. Die beiden Isomere haben fast identische physikalische Eigenschaften, was ihre Trennung besonders schwierig macht.
Weiter führte hier eine von Prof. Dr. Jochen Küpper vom Hamburger Center for Free-Electron Laser Science entwickelte Trennmethode, die auf elektrischen Feldern beruht. Ausgehend davon konnten die Basler Forschenden zusammen mit den Hamburger Kollegen die «vorsortierten» Wasser-Isomere mit ultrakalten Diazenylium-Ionen («protonierter Stickstoff») kontrolliert zur Reaktion bringen. Dabei überträgt ein Diazenylium-Ion einen Wasserstoffkern auf ein Wassermolekül. Diese Reaktion ist auch aus der Chemie des Weltraums bekannt.
Erhöhte Reaktivität
Es zeigte sich, dass para-Wasser um rund 25% schneller reagiert als ortho-Wasser. Dieser Effekt konnte damit erklärt werden, dass der Kernspin auch die Drehbewegung der Wassermoleküle beeinflusst. Als Folge davon herrschen unterschiedlich starke Anziehungskräfte zwischen den Reaktionspartnern. Para-Wasser vermag seine Reaktionspartner stärker anzuziehen als die ortho-Form, was sich in einer erhöhten chemischen Reaktivität auswirkt. Computersimulationen bestätigten diese experimentellen Ergebnisse.
Bei den Experimenten arbeiten die Forschenden mit Molekülen bei sehr tiefen Temperaturen nahe dem absoluten Nullpunkt (etwa –273 °C). Hier herrschen ideale Bedingungen, um Quantenzustände und damit den Energieinhalt einzelner Moleküle zu definieren und diese kontrolliert zur Reaktion zu bringen. Zum Versuchsaufbau erklärt Willitsch: «Je kontrollierter man die Zustände der beteiligten Partikel einer chemischen Reaktion definieren kann, um so präziser lassen sich auch die zu Grunde liegenden Mechanismen und die Dynamik einer Reaktion untersuchen und verstehen».
Originalbeitrag
Ardita Kilaj, Hong Gao, Daniel Rösch, Uxia Rivero, Jochen Küpper, Stefan Willitsch
Observation of different reactivities of para- and ortho-water towards trapped diazenylium ions
Nature Communications (2018), doi: 10.1038/s41467-018-04483-3
Weitere Auskünfte
- Prof. Dr. Stefan Willitsch, Universität Basel, Departement Chemie, Tel. +41 61 207 38 30, E-Mail: stefan.willitsch@clutterunibas.ch
- Prof. Dr. Jochen Küpper, Center for Free-Electron Laser Science, Hamburg, Tel. +49 40 8998 6330, E-Mail: jochen.kuepper@cluttercfel.de
Weiterführende Links
Quick Links