/ Forschung
Paramagnetische Lanthanide ermöglichen die Bestimmung der Proteinstruktur in angeregten Zuständen
Forschende der Universität Basel gewannen völlig neue Einblicke in den Magnetismus von Lanthanid(III)-Komplexen, durch die in Zusammenarbeit mit einer Arbeitsgruppe der Brandeis University (MA, USA) erstmals kurzlebige geringfügig besetzte und hoch-energetische Zustände von Proteinen mittels NMR Spektroskopie charakterisiert werden konnten. Die überraschenden strukturellen Details auf den Energiehyperflächen von Enzymen eröffnen vielversprechende Ansätze für zukünftige Anwendungen dieser neuen Technik.
Häufig werden Proteine durch eine einzige, gemittelte und scheinbar statische Struktur dargestellt, die durch eine Reihe verschiedener Methoden ermittelt werden kann. Schon seit langem ist aber bekannt, dass die Konformations-Landschaften von Proteinen wesentlich komplexer sind und dass gerade die Dynamik dieser Moleküle für ihre einzigartigen Eigenschaften verantwortlich ist.
In der Forschungsgruppe um Prof. Dr. D. Häussinger werden seit fast 20 Jahren sogenannte «Lanthanid-chelatisierende Tags» (LCTs) designed und synthetisiert. Ein LCT besteht aus einem Käfig-ähnlichen Chelator, der das Metallion komplexiert, sowie einer funktionellen Gruppe, die selektiv mit Cysteinresten in Proteinen reagiert und dadurch das Tag kovalent an das Protein anbinden kann. Die räumliche Nähe des paramagnetischen Metallions zum Protein verändert das NMR-Spektrum des Proteins in charakteristischer Weise, so dass sich daraus die Struktur, die Dynamik und die Wechselwirkungen des Proteins mit anderen Molekülen ermitteln lassen. Eine zentrale Rolle spielt dabei der «anisotrope paramagnetische Suszeptibilitätstensor» (χ-Tensor) des Metallions, der sich aus den induzierten NMR-Verschiebungen berechnen lässt.
Diese Lanthanid-induzierten Verschiebungsänderungen werden Pseudokontakt-Verschiebungen (engl. PCSs) genannt. Sie hängen eng mit dem chi-Tensor zusammen und bilden die Basis für eine Analyse der relevanten Eigenschaften des Proteins. Allerdings führt jegliche Bewegung des gebundenen LCTs zu einer Mittelung und damit Verkleinerung der beobachteten PCSs und resultiert in einem scheinbaren χ-Tensor.
Wie lässt sich dieser Bewegungsdrang der Moleküle überlisten?
Vor kurzem gelang Raphael Vogel und Thomas Müntener aus dem Team von D. Häussinger ein Durchbruch im Verständnis der komplexen Zusammenhänge, wie PCSs in Proteinen durch LCTs induziert werden. Dazu musste Raphael Vogel die PCSs der Protonen des isolierten LCTs bestimmen – also ohne den Umweg über das Protein – eine enorme Herausforderung, da alle modernen zwei-dimensionalen NMR-Experimente bei diesen stark paramagnetischen Molekülen versagen. Die Lösung bestand aus einer Kombination von äusserst umfangreichen synthetischen Arbeiten, um nahezu jede einzelne Protonenposition spezifisch durch Deuteriumatome auszutauschen, und einem eleganten kombinatorischen Verfahren, das es erlaubte, für die gesamte Lanthanidreihe die chemischen Verschiebungen aller Protonen im LCT zu ermitteln. Dadurch konnten die «intrinsischen» chi-Tensoren bestimmt und damit der Anteil, der durch die Beweglichkeit verloren geht, erstmals quantifiziert werden. Die sorgfältige Analyse der Resultate ergab eine charakteristische Modulation der räumlichen Orientierung der χ-Tensoren innerhalb der Lanthanidreihe – ein klarer Hinweis darauf, dass der sogenannte Ligandenfeld-Effekt auch für Lanthanide beobachtbar ist. Dies ist der erste experimentelle Beweis der für Lanthanidkomplexe in Lösung erbracht werden konnte – ein Durchbruch mit Konsequenzen nicht nur für die Entwicklung neuer LCTs, sondern für weitere Gebiete wie zum Beispiel die Forschung an Einzelmolekül-Magneten!
Eine neue NMR-Technik entschlüsselt hoch-energetische Proteinzustände
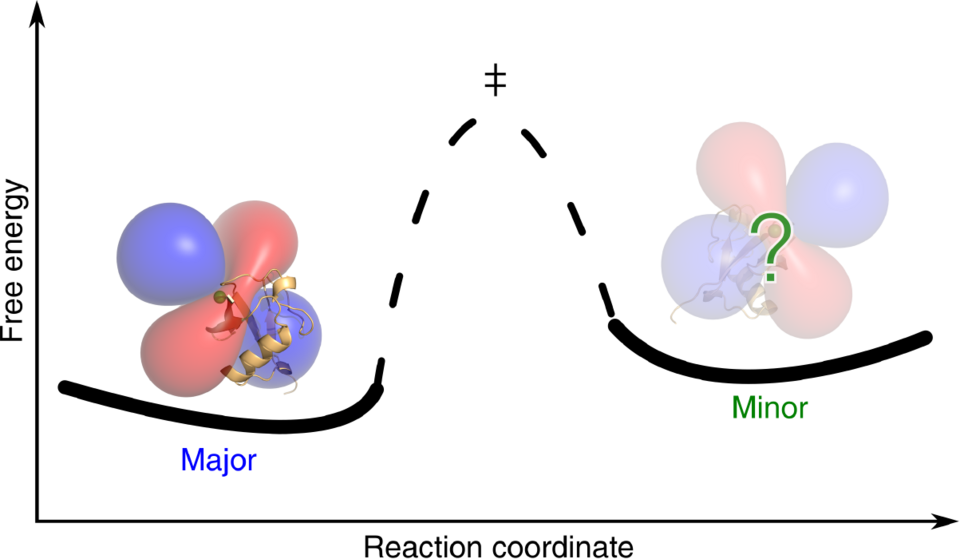
Für ein gegebenes Problem das richtige LCT auszuwählen wird durch diese neuen Erkenntnisse erheblich einfacher, wie sich in einer Zusammenarbeit mit Prof. Dr. Dorothee Kern von der Brandeis Universität (USA) gezeigt hat. Das Team von Frau Kern erforscht den Konformationsraum von Proteinen und interessiert sich insbesondere für kurzlebige hoch-energetische Zustände dieser Eiweissmoleküle. Beispielsweise liegt der Schlüsselschritt bei der Katalyse von Reaktionen durch Enzyme oft in der Besetzung solcher Konformationen, aus denen heraus dann die gewünschte Reaktion erst ablaufen kann. Es ist eine grosse Herausforderung, solche von nur wenigen Prozent der Proteinmoleküle angenommenen und nur kurzlebigen Zustände strukturell mit atomarer Auflösung zu charakterisieren. Diese zu meistern gelang zum ersten Mal durch eine Kombination einer speziellen NMR-Technik, der Carr-Purcell-Meiboom-Gill (CPMG) Relaxationsdispersion, mit PCSs. Die neue Methode namens PCS-CPMG wurde auf drei verschiedene, metallbindende Proteine angewandt, in denen das paramagnetische Metall direkt in das Protein inkorporiert wird. Um diese neue Technik auch für die Mehrheit nicht metallbindender Proteine anwendbar zu machen, waren geeignete LCTs zu finden. Durch genaue Analyse der benötigten Frequenz der Bewegungen des LCTs relativ zum Protein sowie durch sorgfältige Wahl des Lanthanidions gelang Pascal Rieder aus der Forschungsgruppe Häussinger die erste Anwendung der PCS-CPMG Technik mit LCTs. Sowohl für das kleine Protein Ubiquitin, als auch für den dimeren Chaperon-Trigger-Faktor (TF) konnten Bewegungen von einzelnen Peptidschleifen und ganzen Proteindomänen in kurzlebigen hoch-energetischen Zuständen sichtbar gemacht werden, was ein genaueres Verständnis ihrer Wirkungsweisen ermöglicht.
Zukünftige Anwendungen von PCS-CPMG werden dabei helfen, ein wesentlich detaillierteres Bild der Mechanismen in der Enzymchemie zu erhalten, was nicht nur für die Grundlagenforschung sondern beispielsweise auch im Design von Pharmazeutika eine wichtige Rolle spielen könnte.
Originalpublikationen
John B. Stiller, Renee Otten, Daniel Häussinger, Pascal S. Rieder, Douglas L. Theobald, Dorothee Kern
Structure determination of high-energy states in a dynamic protein ensemble
Nature 603/7901 (2022) 528-535. doi: 10.1038/s41586-022-04468-9
Raphael Vogel, Thomas Müntener, Daniel Häussinger
Intrinsic anisotropy parameters of a series of lanthanoid complexes deliver new insights into the structure-magnetism relationship
Chem 7/11, (2021), 3144-3156. doi: 10.1016/j.chempr.2021.08.011
Weiterführende Links
Forschungsgruppe Prof. D. Häussinger
Quick Links